Maddenin yapısını anlamlandırmak için bilinen ilk girişim felsefi bir konsept olarak Antik yunanda Sokrates öncesi filozoflardan olan Demokritos tarafından ortaya konulmuştur. Parmenides’in temsil ettiği tekçilik (monism) ile Empedokles’in çokçuluğu (pluralism) karşısındaki aracılık girişimleri sonucunda, M.Ö 460 yılında ortaya atılmıştır. Günümüze kadar bu yazılarının hiçbiri hayatta kalamamıştır; ancak onun engin yapısından sadece parçalar bilinmektedir.
Varoluş ile ilgili çok kesin bir görüş bildiren bu felsefi düşünceye göre: Evren’deki oluşuma, kesin bir zorunluluk egemendir. Bütün olup bitenleri bir rastlantı ile izah etmeye çalışmak saçmalıktır. “Yaratılmamış, yok olmayan, değişmeyen varlık, özdeksel atomdur. Öz, maddeyi temsil eder ve onunla her nesne yapılabilir.” şeklinde özetlenebilecek bir görüşle, materyalist doğa biliminin ilk temellerini de ortaya koymaktadır. Atomcular, sadece bir hacim, bir şekil ve belki de bir ağırlık içeren bölünemez, küçük bir birim olarak tarif ettikleri atomun ve atomların hareket ettiği boşluğun (eter — ether — esir) ezeli, ebedi mevcudiyetini ortaya atmışlardır. Ancak o kadar küçük boyutları incelemek o dönemlerde pek tabii mümkün olamayacağı için 18. yüzyılın sonlarına kadar pek fazla ilerleme kat edemedi.
Dalton Atom Teorisi
Atom kavramı Demokritos’un fikirlerine dayanıyor olsa da, İngiliz kimyager, meteoroloji uzmanı ve fizikçi John Dalton kimyasal yapıların temel yapı taşının ilk modern tanımını formüle etti. Dalton, Antoine Lavoisier ve Joseph Proust’un çalışmalarını inceleyerek ve genişleterek çoklu oranlar yasasını (ilk olarak 1803’te sunuldu) geliştirdi.
Proust kalay oksitler üzerinde çalışmış ve kütlelerinin ya %88.1 kalay ve %11.9 oksijen ya da %78.7 kalay ve %21.3 oksijen olduğunu keşfetmiştir. Dalton, bu yüzdelerden 100 g kalayın 13.5 g veya 27 g oksijenle birleşeceğini; 13.5 ve 27, 1: 2 oranını oluşturduğunu fark eder. Ve atomik madde teorisinin kimyadaki bu ortak düzeni, yasayı zarif bir şekilde açıklayabildiğini bulur — Proust’un kalay oksitleri, bir kalay atomu bir veya iki oksijen atomuyla birleşecektir.
Dalton ayrıca atom teorisinin suyun neden farklı oranlarda farklı gazları emdiğini açıklayabileceğine inanıyordu: örneğin, suyun karbondioksiti azotu emdiğinden çok daha iyi emdiğini buldu. Dalton, bu durumun da gazların ilgili parçacıklarının kütlesi ve karmaşıklığından dolayı olduğunu düşündü.
Dalton, her kimyasal elementin tek, benzersiz tipteki atomlardan oluştuğunu ve kimyasal yollarla değiştirilememelerine veya yok edilememelerine rağmen, daha karmaşık yapılar (kimyasal bileşikler) oluşturmak için birleşeceği teorisini ortaya attı. Dalton sonuçlarına sezgisel bir şekilde deney yaparak ve inceleyerek ulaştığından, bu atomun yapısına dair ilk gerçek bilimsel teori olarak görülmelidir.
Dalton’un atom teorisinin ana noktaları:
- Her şey maddenin bölünmez yapı taşları olan ve yok edilemeyen atomlardan oluşur.
- Bir elementin tüm atomları aynıdır.
- Farklı elementlerin atomları boyut ve kütle olarak birbirinden farklıdır.
- Bileşikler, farklı tam sayı atom kombinasyonları vasıtasıyla üretilir.
- Kimyasal reaksiyon, reaktan ve ürün bileşiklerinde atomların yeniden düzenlenmesine yol açar.
Atom teorisi yıllar içinde atomik izotopların varlığını ve kütle ile enerjinin karşılıklı dönüşümünü içerecek şekilde revize edilmiştir. Ek olarak, atom altı parçacıkların keşfi ile, atomların daha küçük parçalara ayrılabileceği ortaya çıkmıştır. Ancak yine de Dalton’un modern atom teorisinin gelişimindeki önemi, atomik kütle biriminin Dalton olarak adlandırılmasıyla kabul edilmiştir.
Thomson Atom Modeli
J. J. Thomson’ın katot ışınları üzerine gerçekleştirdiği çalışmalara yani elektronun 1897 yılındaki keşfine kadar atomların mümkün olan en küçük temel parçacık olduğu düşünülüyordu.
J.J.Thomson daha sonra atomların bölünmez olmadığını ve bu küçük taneciklerin de birer yapı taşı olduğunu öne sürdü. Elektronun atom modeline dahil edilmesi için atom çekirdeğinin keşfinden önce 1904’te Thomson Atom Modeli olarak da bilinen “erik puding modeli”ni önerdi.
Bu model için Thomson aşağıdaki çıkarımlarda bulundu:
- Elektron atom içinde pozitif yüklü bir parçacık ile eşleşir ve atom içinde nereye giderse gitsin bu parçacık tarafından takip edilir.
- Negatif yüklü elektronlar atomun merkezine doğru yoğunlaşan tüm elektronların toplam yüküne eşit miktarda yükü olan pozitif yüklü merkezi bir alanın çevresinde bulunmaktadır.
- Negatif yüklü elektronlar, homojen pozitif yüke sahip olan bir uzayın içinde bulunmaktadırlar.

Thomson bu modelle, atomun önemsiz girdaplardan oluştuğu önceki “bulutsu atom” hipotezini terk etti. Şimdi, atomun en azından bir kısmı Thomson’un partikül negatif taneciklerinden oluşacaktı, ancak atomun pozitif yüklü kısmının geri kalanı biraz belirsiz ve kötü tanımlanmış olarak kaldı.
1904 Thomson modeli, Hans Geiger ve Ernest Marsden tarafından yapılan 1909 altın folyo deneyi ile onaylanmamıştı. Daha sonralarda, bu altın folyo deneyi 1911’de Ernest Rutherford tarafından çok yüksek bir pozitif yük içeren atomun çok küçük bir çekirdeği olduğunu (altın durumunda, yaklaşık 100 elektronun kolektif negatif yükünü dengelemek için yeterli olduğunu) önerdi. Ve bu şekilde Thomson’ın modeli eski öğrencilerinden biri olan Ernest Rutherford tarafından çürütülmüş oldu. Bu yeni model Rutherford Atom Modeli adını alacaktı.
Rutherford Atom Modeli
Rutherford, 1909’da ünlü Geiger-Marsden deneyini yönetti; Rutherford’un 1911 yılındaki analizine göre J. J. Thomson’un atomun “erik puding modeli” nin yanlış olduğunu öne sürdü. Rutherford’un yeni atom modeli, deneysel sonuçlara dayanarak, atomun geri kalanına kıyasla çok küçük bir hacme konsantre edilmiş nispeten yüksek bir merkezi yükün yeni özelliklerini içeriyordu. Bu merkezi hacim ayrıca atomun kütlesinin büyük bir kısmını içeriyordu. Bu bölge daha sonra “çekirdek” olarak adlandırılacaktı.
1911’de Rutherford, radyoaktif bir element tarafından yayılan alfa parçacıklarını kullanarak atomik yapıyı daha da araştırmak için bir deney tasarladı. Bu deneyde, Geiger ve Marsden, büyük kinetik enerjili alfa parçacıklarını ince bir altın folyoya doğru fırlattı. Saçılmış parçacıkların deseninin ölçülmesinin, yükün atom içindeki dağılımı hakkında bilgi sağlaması bekleniyordu. O zamana kadar geçerli olan erik pudingi modeline göre, alfa parçacıklarının tümü en fazla birkaç derece saptırılmış olmalıydı. Ancak, gerçek sonuçlar Rutherford’u şaşırttı. Alfa parçacıklarının çoğu beklendiği gibi geçmesine rağmen, birçoğu küçük açılardan saptırılırken, diğerleri alfa kaynağına geri yansıtıldı. Deneyi sonuçların ardından geniş bir kabul görerek; ilk atom modeli denildiğinde akla ilk gelen model olarak akıllara kazındı.
Ancak bu modelin en büyük eksiklikliği negatif yüklü elektronların neden pozitif yüklü çekirdeğe düşmediğine çözüm bulamayışıdır. Bu bir süreliğine daha gizem olarak kalmaya devam etti.
Bohr Atom Modeli
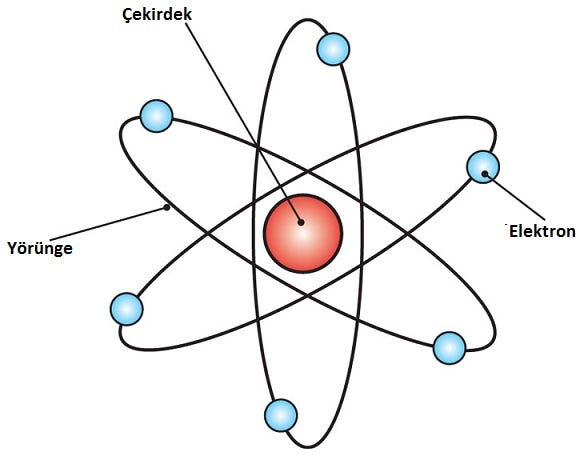
Daha sonralarda, geliştirilen Bohr atom modeli esasında Rutherford atom modeline eklemeler yapan bir paket gibiydi. Bu yüzden Rutherford-Bohr atom modeli anılmaktadır.
Büyük Danimarkalı fizikçi Niels Bohr (1885–1962) Rutherford’un atomunun modelini değerlendirerek, geçerliliğine ikna oldu. 1912’nin bir kısmını Rutherford’un laboratuvarında geçirdi. 1913’te Kopenhag’a döndükten sonra, atomun gezegen modeline dayanarak en basit atom olan hidrojen teorisini yayınlamaya başladı.
On yıllar boyunca atomik özellikler hakkında birçok soru soruldu. Boyutlarından spektrumlarına kadar atomlar hakkında çok şey biliniyordu, ancak fizik yasaları açısından çok az şey açıklanmıştı. Bohr’un teorisi, hidrojenin atom spektrumunu açıkladı, onu anında ünlü yaptı ve kuantum mekaniğinde yeni ve geniş çapta uygulanabilir ilkeler oluşturdu.

Rutherford atom modelinin sahip olduğu en büyük bulmaca şuydu: Klasik mekanik yasaları, bir çekirdeğin etrafında dönerken elektronun elektromanyetik radyasyon yayması gerektiğini öngörmektedir (Maxwell denklemlerine göre, hızlanan yük elektromanyetik radyasyon yaymalıdır). Bu modelde, elektron, enerji kaybedeceğinden, çekirdeğe düşme eğilimi gösterme eğilimindeydi. O yüzden bu atom modeli felakettir, çünkü tüm atomların kararsız olduğunu tahmin eder. Ayrıca, elektron içe doğru sarıldıkça, yörünge küçüldükçe ve hızlandıkça emisyon yavaş yavaş artacaktır. Bu, sürekli olarak elektromanyetik radyasyon üretecektir.
Bu zorluğun üstesinden gelmek için Niels Bohr, 1913’te atomun Bohr modeli olarak adlandırılan modeli önerdi. Elektronların sadece bazı klasik hareketlere sahip olabileceğini söyleyerek aşağıdaki çıkarımlarda bulundu:
- Atomlardaki elektronlar çekirdeğin etrafında döner.
- Elektronlar, belirli yörüngelerde (Bohr tarafından “sabit yörüngeler” olarak adlandırılır), çekirdekten belirli bir uzak mesafeler kümesinde yayılmadan kararlı bir şekilde yörüngede kalabilirler. Bu yörüngeler belirli enerjilerle ilişkilidir ve enerji kabukları veya enerji seviyeleri olarak da adlandırılır. Bu yörüngelerde elektronun hızlanması, klasik elektrodinamiğin gerektirdiği gibi radyasyon ve enerji kaybıyla sonuçlanmaz.
- Elektronlar sadece izin verilen bir yörüngeden diğerine atlayarak, frekansta elektromanyetik radyasyonu emerek veya yayarak enerji kazanabilir ve kaybedebilirler.
Bu çıkarımlara göre elektronların çekirdeğe düşmeme nedeni çözümlenmiş oluyordu, ancak bu açıklamanın hatalı olduğu Heisenberg tarafından ortaya atılan belirsizlik ilkesi ile ortaya çıktı. Bu ilkenin önerisine göre bir kuantum parçacığının hem momentumunu hem de konumunu aynı anda bilebilmemiz mümkün değildir. Ancak Bohr modelinde tek bir yörüngede hareket eden elektron fikri bu ilke ile ters düşmektedir çünkü eğer konumunu biliyorsak momentumunu bilemememiz gerekir; fakat Bohr modeli sadece hangi yörüngede olduğunu görebilmenin ötesinde momentumunu da ön görebilmekteydi.
Schrödinger Atom Modeli
20. yüzyılın başlarında birbiri ardına gerçekleşen müthiş bilimsel keşifler kuantum mekaniğinin gittikçe daha sağlam bir alt yapı kazanmasıyla madde olarak adlandırdığımız olguya bakışımızı da ciddi bir şekilde değiştirdi. Bu yeni bakış açısına göre kuantum parçacıklarının davranışları geleneksel madde algımızdan oldukça farklıydı. Bu olay en belirgin şekliyle ile çift yarık deneyinde gözlemlenmektedir.
1926’da Avusturyalı fizikçi Erwin Schrödinger (1887–1961), elektronun bir hidrojen atomundaki davranışını doğru bir şekilde tanımlayan karmaşık bir matematiksel denklemi geliştirmek ve çözmek için elektronun dalga-parçacık ikililiğini kullandı. Denklemin çözülmesi için elektron enerjilerinin nicelendirilmesi bir gerekliliktir. Bu, nicemlemenin basitçe matematiksel bir temel olmaksızın varsayıldığı Bohr modelinden farklıdır.
Bohr modelinde, elektronun kesin yolunun çekirdeğin etrafındaki çok iyi tanımlanmış dairesel yörüngelerle sınırlı olduğunu hatırlayın! Kuantum mekanik model bundan çok daha radikal bir öneridir. Dalga fonksiyonları olarak adlandırılan Schrödinger dalga denkleminin çözümü, çekirdeğin etrafında belirli bir noktada bir elektron bulma olasılığını verir. Elektronlar basit dairesel yörüngelerde çekirdeğin etrafında dolaşmazlar.
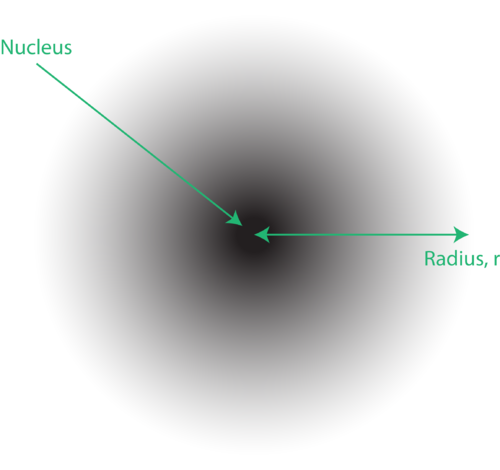
Atomun kuantum mekanik modelindeki elektronların yeri genellikle elektron bulutu olarak adlandırılır. Elektron bulutu şu şekilde düşünülebilir: Çekirdeği temsil eden dairede bir nokta bulunan yere kare bir kağıt parçası yerleştirdiğinizi düşünün. Şimdi bir işaretleyici alın ve tekrar tekrar kağıda bırakın, işaretleyicinin vurduğu her noktada küçük işaretler yapın. İşaretçiyi birçok kez düşürürseniz, noktaların genel deseni kabaca dairesel olacaktır. Eğer merkeze doğru iyi nişan alırsanız, çekirdeğin yakınında daha fazla nokta ve ondan uzaklaştıkça giderek daha az nokta olacaktır. Her nokta, elektronun herhangi bir anda olabileceği bir konumu temsil eder. Belirsizlik ilkesi nedeniyle, elektronun tam olarak nerede olduğunu bilmenin bir yolu yoktur.
Bulutun şeklini spesifik olarak tanımlamak için, içinde elektron bulunma olasılığının %90 olduğu alan bölgesine atıf yapmak gelenekseldir. Buna yörünge denir, uzayın üç boyutlu bir bölgesi, elektron bulma olasılığının yüksek olduğunu gösterir.
Sonuç
Bilim heyecan verici bir serüven, sonu olmayan bir ırmaktır. Atom modellerimizi tanıdığımız bu içerikte, içerisinde bulunduğumuz doğayı ve maddeyi sezgisel olarak anlama çabalarıyla başlayan bu serüvenin bizleri nerelere ulaştırdığını kısaca da olsa incelemiş olduk.
Kaynakça
- Berryman, Sylvia, “Ancient Atomism”, Stanford Encyclopedia of Philosophy (Fall 2008 Edition), Edward N. Zalta (ed.)
- Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978–0–19–515040–7.
- Britannica -Democritus -https://www.britannica.com/biography/Democritus
- http://www.boundless.com//chemistry/definition/atomic-mass-unit
- Quantum Mechanical Atom Model — https://courses.lumenlearning.com/cheminter/chapter/quantum-mechanical-atomic-model/
- Mahanti, Subodh. “Erwin Schrödinger: The Founder of Quantum Wave Mechanics”. 17 Nisan 2009 tarihinde kaynağındanarşivlendi. Erişim tarihi: 1 Ağustos 2009.
- Mahanti, Subodh. “Max Born: Founder of Lattice Dynamics”. 22 Ocak 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Ağustos 2009.
- Greiner, Walter. “Quantum Mechanics: An Introduction”. Erişim tarihi: 14 Haziran 2010.
- Heisenberg, W. (1927). “Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik”. Zeitschrift für Physik(Almanca). 43 (3–4), s. 172–198. Bibcode:1927ZPhy…43..172H. doi:10.1007/BF01397280.
- Milton Orchin; Roger Macomber; Allan Pinhas; R. Wilson. “The Vocabulary and Concepts of Organic Chemistry, Second Edition,”(PDF). Erişim tarihi: 14 Haziran 2010.










Yoruma kapalı.